はじめに
従来までの口腔がんの治療は、手術治療が第1選択であり、手術不可能な症例、あるいは適切な手術が行えなかった症例に対して、補助的に放射線治療や化学療法が行われてきた。しかし、近年においては、それぞれの治療法も大きな進歩を遂げ、手術を行わず、放射線療法単独もしくは化学療法と併用することにより治癒を期待できるようになってきた。また、これら3つの治療法に続く第4の治療法として期待されてきたものに免疫療法がある。手術療法や放射線療法はがんが局所に限局される場合に有効な治療法であるが、この免疫療法は、化学療法とともに薬物療法として、がんを全身病(全身に広がったがん)と捉えた場合に有効な治療法であると考える。
本編では、放射線療法、化学療法の基本的な概念とそれらの最新の治療法とともに、臨床研究としての位置づけであるが、当科で行っている免疫療法の1つを紹介する。
放射線療法
-
放射線療法と適応
がんに対する放射線療法は、一般に癌細胞が正常細胞より放射線感受性が高く、障害を受けやすい性質を持っていることを利用して、放射線による正常組織の損傷を許容できる範囲に抑えながらがん細胞を死滅させる、あるいは少なくとも増殖できない程度にまで制御しようとするものである。
正常組織の放射線感受性は組織の種類により異なるが、がん組織の放射線感受性は、それが由来する正常組織の放射線感受性におおむね依存する(表1)。

そのため、放射線治療の適応は、正常組織と比較して対象となるがんの放射線感受性が高いことが必要となる。さらに、腫瘍組織の縮小効果は線量の増加とともに顕著となるが、正常組織傷害性も高くなるため、使用線量は治療可能比 therapeutic ratio(TR)によって決められている。この比が1より十分大きければ成功率が高いと考えられるが、1より小さい場合は治療が成り立たない。
腫瘍組織の放射線感受性が十分高い悪性リンパ腫、精上皮腫などの場合は(TR>1)、放射線治療による治癒の可能性が十分に考えられるが、放射線感受性が中等度の扁平上皮癌や腺癌などの場合では(TR≧1)、あるものは治癒する可能性も十分あるが、あるものは治癒させるのが困難なものもある。
口腔がんは、病理組織学的には扁平上皮癌、腺様嚢胞癌、肉腫、悪性リンパ腫などが挙げられる。なかでも扁平上皮癌は約90%を占めている。これら口腔領域の悪性腫瘍は放射線感受性からみても、ほとんどが中等度以上であり、また部位的にも直視、直達が可能であり、放射線治療の適応が広いと言える.
口腔がんに対する放射線治療
口腔がんに対する放射線療法は、体外照射療法(EBRT)単独または密封小線源治療単独を実施できるが、多くの部位ではこの両者を併用して、優れた制御および機能的な結果を生み出している。
・小線源治療
正常組織の照射後の副作用を減らし、原発巣への効果的な照射法として密封小線源を用いた組織内照射、モールド照射がある。しかし、その適応例の選択には細心の注意が必要となる。適応例はT1~T2例であるが、腫瘍に厚みのある場合は適応外であり、表在癌がこの治療の対象である。線源としては 198Au grain が一般的であるが、口腔底への組織内照射には137Cs針も使用される。線量評価点は線源中心より5mmの面で評価することが一般的であり、総投与線量は腫瘍の性状、大きさ、外照射線量の多寡により調整する1)。
・外部照射
大きな病変は、臨床的に転移がない場合でも、原発部位および所属リンパ節を含むように、体外照射療法によって治療を行うことが多い。基本的にはシェルでの患者固定を行い、口腔内にマウスピース等を挿入させシェルを装着させる。これにより下顎歯肉・歯槽、口腔底の照射時に口蓋部を照射野からはずすことが可能となり、また上顎歯肉・歯槽、硬口蓋の照射時には舌への照射領域を軽減できる利点がある。しかし、放射線療法が長期にわたれば重大な局所制御不能に陥ることが示唆されている2, 3)。
・術後放射線療法
術後の照射は原発巣の断端陽性例、頸部リンパ節の被膜外進展例や複数のリンパ節転移を認めた例に行われる。断端陽性例では60Gyの照射が必要であるが、予防照射例では50~56Gy前後の照射が行われることが多い。
2.最新の放射線治療
・サイバーナイフ治療
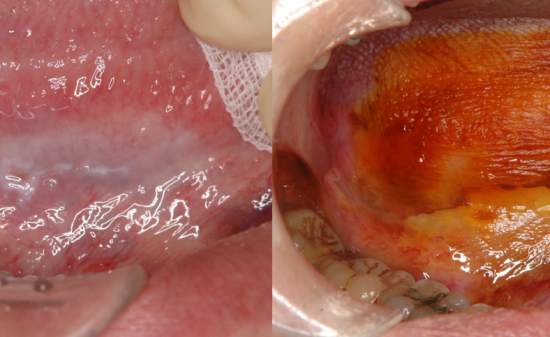
サイバ-ナイフとは定位放射線治療を行う放射線照射装置の一つであり、精密に放射線を照射できる最新鋭器である。1992年、アメリカで開発され、そのロボットアームの動きは、巡航ミサイルが動く標的を追跡して撃ち落とす軍事技術を応用しており、照射の誤差は1ミリ以内と精度が高くメスのような鋭い切れ味の「電脳ナイフ」が名前の由来(図1-a,b)。
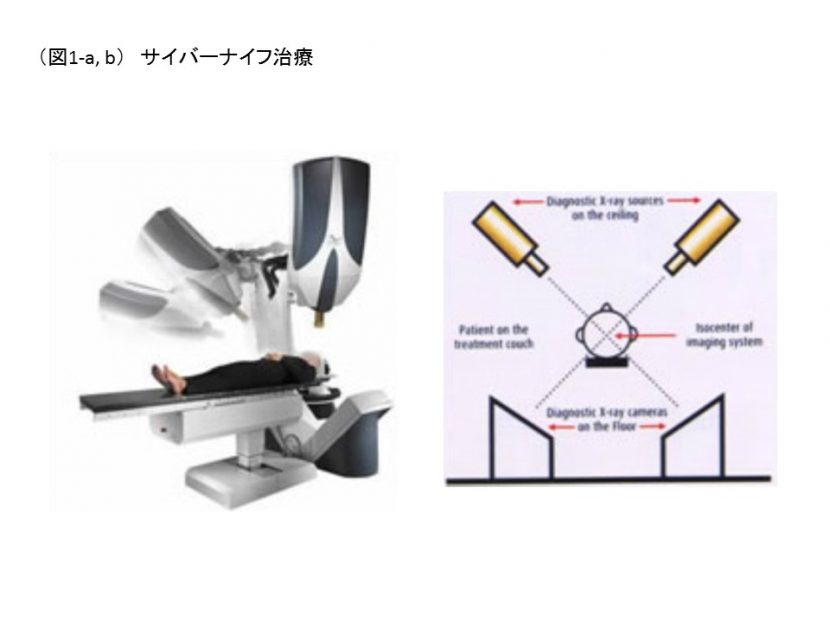
口腔がんに対する放射線治療としては、通常の放射線では、腫瘍だけでなく正常な細胞も破壊するが、サイバーナイフは患部のみに放射線を照射し、腫瘍を壊すことができる。周りの正常組織を守りながら、直径3cmを超える腫瘍にも適応できる。また、「病変追尾システム」により、コンピューターが常に患者の位置を認識し、1cm以内の動きであれば病変を追尾し治療できることから、頭部の強固な固定がなくても、高精度の放射線治療ができる装置として開発された。また、最大1200方向から照射でき、病変部の形状に一致した安全な治療が可能となっている。サイバーナイフによるがん治療では、通常の放射線治療に比べ、長期の入院や通院が不要であり、また、治療にメスを使わないので、全く痛みはなく、傷跡も残らず、体に大きな負担をかけることがない。
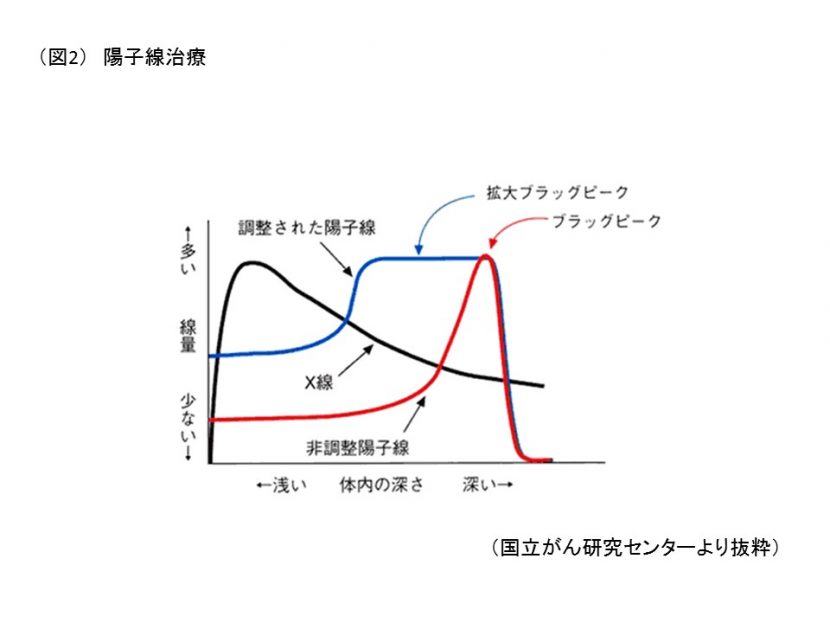
・陽子線治療
陽子線治療とは、水素の原子核である陽子を光速近くまで加速し、がんの病巣に衝突させることによりがん細胞を消滅させる新しい放射線治療である。従来の放射線治療との大きな違いは、体内での放射線の分布の違いにある。従来の放射線治療では体表面近くで線量が最大になり、徐々に線量が減少するのに対し、陽子線は止まる直前に高い線量を体内に落とす特徴(ブラックピーク)がある。そのため、がんにより多くの放射線を集中して照射(狙い射ち)することができる。陽子線が体内で照射されると、正常な細胞はほとんど影響されること無く、がん細胞に到達する。その際、がん細胞のDNAを直接あるいは間接的に損傷させる。これにより、従来の放射線治療では生き返ってしまうがん細胞に対しても、陽子線は大きな効果が期待できる( 図2)。

・強度変調放射線治療(IMRT)
化学療法
癌の化学療法は化学物質(抗がん剤)を用いてがん細胞の分裂を抑え、がん細胞を死滅させる治療法である。抗がん剤は静脈に注射するか、内服すると血液中に入り、全身の隅々まで運ばれて体内に潜むがん細胞を攻撃し、死滅させます。全身のどこにがん細胞があってもそれを死滅させる力を持っているので、全身的な治療に効果がある。がんは全身病と呼ばれるように、早期にはある部位に限定している局所の病巣が、次第に全身に広がり(転移)、全身的な病気となる。3大療法と呼ばれるがん治療のうち、外科療法と放射線療法は局所的ながんの治療には非常に強力だが、全身病を治すということからすると化学療法は最適ながん治療法です。化学療法の効果のほどは、現段階では癌(がん)の性質や病期によって異なる。化学療法は外科療法や放射線療法などを組み合わせて治療に用いられる事が多くなっている。
・口腔癌治療における薬物療法
強度変調放射線治療(Intensity Modulated Radiation Therapy: IMRT)とは、コンピューターの助けを借りて正常組織の照射線量を抑えつつ腫瘍部分に放射線を集中して照射できる。これにより、従来法では不可能であった理想的な放射線治療が可能となり、腫瘍制御率の向上や合併症の軽減が期待される。臓器に近接した複雑な形状をもつ複数のターゲットに対しても自在に線量を調整投与することができ、放射線治療の可能性を大きく広げる革新的治療法である。すでに一部の先駆施設より、前立腺がん・頭頸部がん・中枢神経がんにおいては有望な臨床成績が報告されており、その他の多くのがん種で治療成績向上や合併症の軽減が期待されている。特に、腫瘍が正常組織を取り囲むように位置している場合、正常組織を避けて腫瘍に十分量の照射をすることは事実上不可能である。これは、通常の照射方法では、各ビーム内の強度が均一であるために照射野内の線量も基本的に均一となるからであり、IMRTは1方向のビームを更に小さなセグメントという単位で分割して照射し、理想的なビームパターンを作成する。
- 術前化学療法(術前に抗がん剤による治療により腫瘍の力を弱めるもの)
- 術後補助療法(術後に手術をした部位で全身に散らばっているかも知れないがん細胞を死滅させるために行う治療)
- 手術ができない口腔癌に対する治療・使用される抗がん剤 現在,口腔癌を含む頭頸部癌においては,白金製剤をベースにした化学療法と放射線との同時併用療法が,他剤との併用療法に比べ明らかに予後を改善したことが示されている。最近では分子標的治療薬を用いた臨床試験が実施されている4)。
放射線・化学併用療法
口腔癌に対する治療の主役は手術や放射線治療である。しかし、初診の時点でステージⅢ・Ⅳ期の進行例が60%以上であるこの疾患においては、これらだけでは治療成績に限界があるため、化学療法と併用した治療が有用である。また、口腔癌の治療では咀嚼,嚥下,構音機能の温存や審美的な側面から形態の温存が強く要望される。近年では,進行癌に対して化学放射線療法を根治療法として施行し,完全寛解が得られた場合には手術回避し,効果が得られなかった症例にのみ救済手術を施行するという治療形態がとられてきている。切除可能進行例に対しては,口腔癌の原発巣に対する本療法の臨床的効果と組織学的効果の相関性が認められ,臨床効果の高い症例に対する手術回避や縮小手術の可能性が示されており,臓器・機能温存療法として期待されている5, 6)。また,下咽頭癌や喉頭癌においては,放射線療法単独に比べ生存率に上昇は認められないものの原発部位や頸部の臓器温存率が有意に上昇したという報告がある。一方,切除不能例に対する報告では,口腔癌を含む頭頸部癌において多数の第Ⅲ相比較試験があり,放射線療法単独に比べ粘膜炎や骨髄抑制などいくつかの副作用の増強が認められるものの原発巣・頸部制御率,生存率ともに有意に優れていることが示されており,標準的治療法と考えられている4)。
- 代謝拮抗剤として 5-FUやUFT,テガフール,MTXなどが従来から使用されていたが,最近では,テガフールを基盤としたTS-1も用いられている。また,抗生物質では,BLMやPEPがその代表例であり,白金製剤としては,CDDPやCBDCA,CDGPなどがある。また,植物アルカロイドとしてTXTも用いられることが多いが,通常単独ではなく多剤併用により行われる場合が多い。
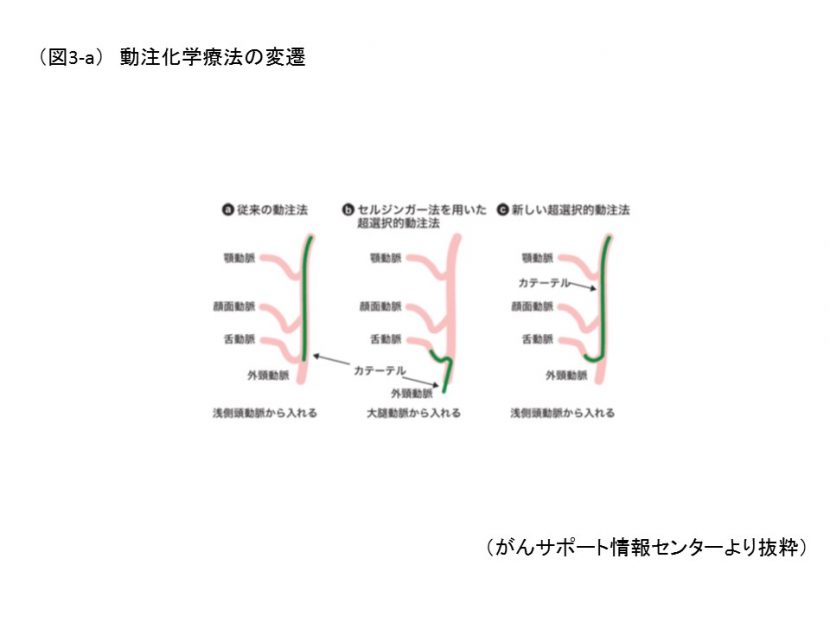
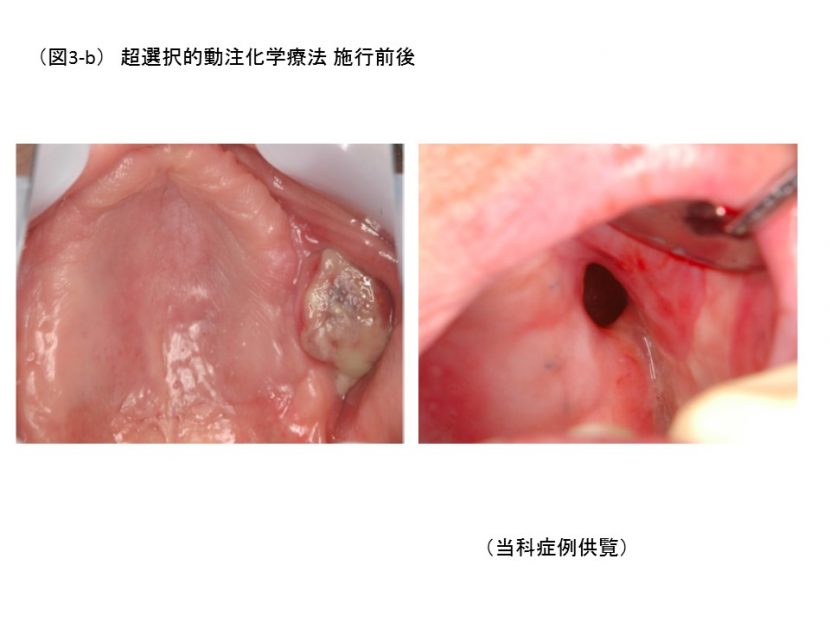
- 動注化学療法
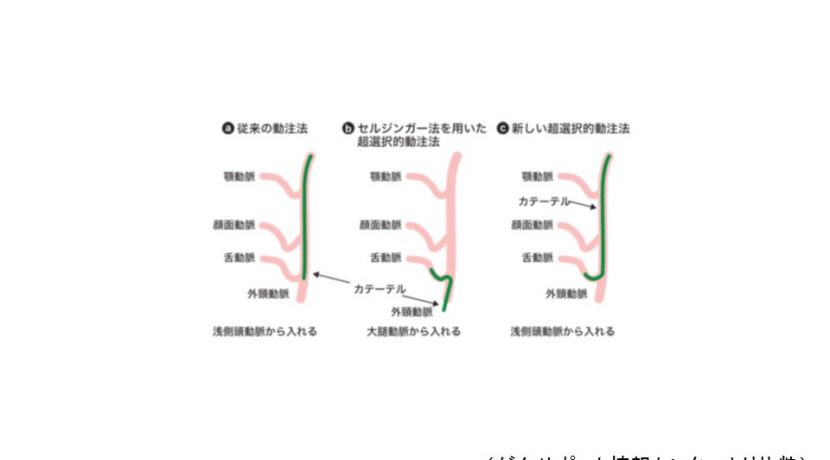
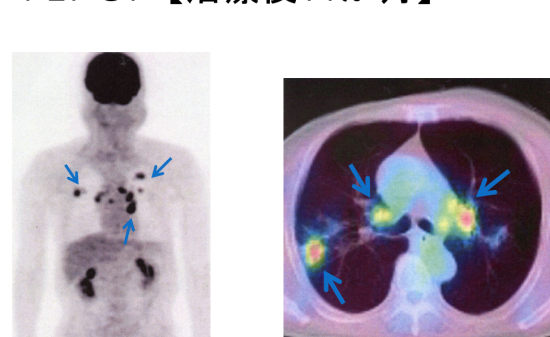
- 前述のごとく、口腔領域の進行がんの手術は、たとえがんは取り切れたとしても、会話や食事などの機能低下や、容貌が大きく損なわれ、患者の心身への影響が大きい。そのため手術以外の方法として、大量の抗がん剤を患部に集中的に注入するとともに、放射線を併用する動注化学療法がある。この治療法は1950年代にすべてのがんのうち、最初に頭頸部癌に対して行われた。浅側頭動脈より外頸動脈に逆行性に挿入留置する方法が一般的であった。このため、抗がん剤の注入領域が腫瘍領域のみならず正常組織にまでおよび、腫瘍内濃度が十分に得られない。そこで1994年Robbinsらは、鼠径部の大腿動脈より順行性にカテーテルを挿入し、血管造影下に、がんの栄養血管まで到達させ、そこにシスプラチンという抗がん剤を注人するSeldinger法による超選択的動注化学療法を行い、同時に放射線治療を併用することで、生存率向上に寄与すると報告した7)(図3-a,b)。しかし、シスプラチンは腎障害、吐き気といった副作用が起きやすい。そこで、抗がん剤の注入と同時に、鎖骨下静脈に入れた別のカテーテルから、抗がん剤を中和する薬(チオ硫酸ナトリウム)を注入することにより、抗がん剤はがんの部位に流れた後、全身に循環する前に中和され、副作用を最小限に抑えることができる。抗がん剤を静脈に注射する従来の治療は、副作用のため3-4週の間隔を空けて行う必要があるが、この方法では毎週、しかも2倍量の抗がん剤を投与でき、高い効果が期待できる。基本的な治療期問は7週間で、抗がん剤を週1回、計4回、並行して放射線を週4回(1回2.5Gy)、計65Gy照射する。
・免疫療法
近年、T細胞の抗原を認識するメカニズムが明らかになると共に、腫瘍抗原の中に腫瘍抗原としてCTLに認識されるタンパク質が発見され、腫瘍抗原やその抗原遺伝子を利用した治療法の検討が開始されている。
悪性黒色腫では、同定されたこの腫瘍拒絶抗原ペプチドを用いた免疫治療がいち早く行われ実施され、その成果が1998年よりRosenbergらを中心に報告されている8,9)。その後、IL-2やGM-CSFとの併用、複数の腫瘍拒絶抗原ペプチドを投与するプロトコールや改変ペプチドの開発、ペプチドパルス樹状細胞の臨床試験など、現在も腫瘍拒絶抗原ペプチドを用いた抗腫瘍免疫療法は、外科手術や化学療法など従来の治療法を補完する治療法として注目されている。
細胞傷害性T細胞(CTL)によって認識・傷害される腫瘍抗原が発見され、その後、腫瘍特異的抗原が次々と同定され、これを標的とする特異的免疫療法であるエピトープペプチドを用いたがんワクチン療法の臨床試験が進行中であるが、CTLによって認識・傷害される腫瘍抗原について、腫瘍細胞には高発現するが正常細胞には発現せず、強い免疫原性を有する等の理想的な条件を満たす腫瘍抗原の例は少ないこと、また、同定された腫瘍抗原の多くは悪性黒色腫が対象であり、消化器領域の癌や、口腔癌については、現在のところきわめて限られているのが現状である。しかし、近年、cDNAマイクロアレイ法の開発により、腫瘍における数多くの遺伝子発現を網羅的に探索でき10-12)、腫瘍の性質、特徴が遺伝子レベルで解析できるようになった13)。この手法を用いてヒト遺伝子23,040個の中から食道癌に高頻度に高発現し、正常臓器には発現していない遺伝子を見出し、その遺伝子由来でHLA拘束性のエピト-プペプチドを同定する方法により食道癌のワクチン療法に用いる新規腫瘍抗原を決定した14)。
CDCA1(cell division cycle associated gene 1)は1番染色体長腕に存在し、464のアミノ酸からなる核内蛋白で、細胞増殖に関与している。扁平上皮癌に高発現しており、正常臓器では精巣でのみ発現が認められる。CDCA1も同様に、免疫原性を有しており、CDCA1を特異的に認識・傷害するCTLを誘導するがんワクチン療法に応用できるエピトープペプチドである。また、KOC1(insulin-like growth factor 2 mRNA binding protein 3)は、7番染色体短腕に位置し、579アミノ酸からなる細胞質内蛋白で細胞増殖に関与している。この蛋白質も口腔癌で高発現しており、正常臓器には、精巣・胎盤でのみ発現している。KOC1も同様に、免疫原性を有しており、KOC1を特異的に認識・傷害するCTLを誘導するがんワクチン療法に応用できるエピトープペプチドである。現在、これらのペプチドワクチンを用いた臨床研究が行われており、その効果が期待されている。
参考文献
- Inoue T, Inoue T, Yamazaki H, et al. High dose rate versus low dose rate interstitial radiotherapy for carcinoma of the floor of mouth. Int J Radiat Oncol Biol Phys 41: 53-58, 1998.)
- Fowler JF, Lindstrom MJ: Loss of local control with prolongation in radiotherapy. Int J Radiat Oncol Biol Phys 23 (2): 457-67, 1992.
- Langendijk JA, de Jong MA, Leemans ChR, et al.: Postoperative radiotherapy in squamous cell carcinoma of the oral cavity: the importance of the overall treatment time. Int J Radiat Oncol Biol Phys 57 (3): 693-700, 2003.
- 日本癌治療学会:がん診療ガイドライン
- Iguchi, H., Kusuki, M., et al.: Outcome of preoperative concurrent chemoradiotherapy and surgery for resectable lingual squamous cell carcinoma greater than 3cm: the possibility of less extensive surgery. Oral Oncol. 42:391-397, 2006.
- Fuwa N., et al.: A combination therapy of continuous superselective intraarterial carboplatin infusion and radiation therapy for locally advanced head and neck carcinoma. Phase I study. Cancer. 2000 Nov. 15; 89(10): 2099-105.
- Robbins KT., et al.: A targeted supradose cisplatin chemoradiation protocol for advanced head and neck cancer. Am J Surg. 1994 Nov; 168(5): 419-22.
- Celis E., et al.: Epitope selection and development of peptide based vaccines to treat cancer. Cancer Biology 6:329-336,1995
- Marchard M., et al.: Tumor regression in melanoma patients treated with a peptide encoded by gene MAGE-3. Int.J.Cancer 63:883-885,1995
- Okabe, H., et al.: Genome-wide analysis of gene expression in human hepatocellular carcinomas using cDNA microarray: identification of genes involved in viral carcinogenesis and tumor progression. Cancer Res., 61, 2129-2137, 2001.
- Lin, Y-M., et al.: Molecular diagnosis of colorectal tumors by expression profiles of 50 genes expressed differentially in adenomas and carcinomas. Oncogene, Oncogene. 21:4120-4128, 2002.
- Hasegawa, S., et al.: Genome-wide analysis of gene expression in intestinal-type gastric cancer using cDNA microarray representing 20340 genes. Cancer Res. 62:7012-7017, 2002.
- Bienz, M. and Clevers, H. : Linking colorectal cancer to Wnt signaling. Cell 103, 311-320, 2000.
- Suda T et al. : Identification of severnin 1 (SCRN1) as a novel immunotherapy target for gastric cancer using the expression profiles of cDNA microarray. Cancer Sci 97(5) 411-419,2006











 PAGE TOP
PAGE TOP